肝细胞癌类器官培养基(Hepatocellular Carcinoma Organoid)
产品货号:RSQ-OCM1006
无血清培养基,成分明确
人肝癌类器官培养试剂盒说明书
|
产品及货号 |
包装规格 |
组分编号 |
组分名称 |
包装 |
|
人肝细胞癌类器官培养试剂盒 (RSQ-OCK1006-Kit) |
3-5例 |
RSQ-OCM1006 |
肝细胞癌类器官培养基 |
100ml |
|
RSQ-OSR001 |
组织消化液 |
50ml |
||
|
RSQ-OSR003 |
类器官消化液 |
40ml |
||
|
RSQ-OSR004 |
类器官冻存液 |
40ml |
||
|
RSQ-OSR002 |
组织保存液 |
100ml |
||
|
RSQ-OSR005 |
清洗液 |
500ml |
保存条件:-20℃ ~ 4 ℃保存。保质期6个月
实验流程
- 从原代组织建立类器官
注意:涉及到人原代组织的研究,须遵循国家人类遗传资源管理条例,符合所有相关的机构和政府规定,并获取伦理委员会批准。在收集人原代组织材料之前,须得到受试者的知情同意。
类器官培养基、组织消化液储存温度:-20℃ ~ 4℃。
- 人肝癌组织取样
- 检查组织保存液是否过期、漏液以及有无变色或浑浊。
- 于无菌条件下打开组织保存液,将组织保存液分装至15ml或50ml无菌离心管中,请尽量缩短保存液在空气中的暴露时间。
- 将人肝癌组织取下,用无菌镊将肝癌组织放于组织保存液中。
【注1】:组织取样详情请参考常见问题1。
- 确保样本组织完全浸泡于液体后,立即旋紧管盖,并用封口膜将管盖和管颈的缝隙密封。
- 注意样本离体后应尽快放入组织保存液中。样本在环境中暴露时间越长,活性越低,受污染的风险也越高。
【注2】:组织样本在保存液中的正确保存方式参考常见问题2。
- 运输
经组织清洗液清洗后的肝癌样本尽快放入组织保存液中,样本须4℃低温保存和快速转运,确保样本安全、准确、及时送达实验室进行后续类器官构建工作。
- 组织清洗
- 将样本组织放置于培养皿中,剪成米粒大小(2-4mm3).
【注3】:若在剪切时有肿瘤细胞掉落,可收集清洗液,离心后去上清加入新的清洗液,再次离心去上清,反复清洗3次。清洗结束后的细胞沉淀可直接与基质胶混匀后种到细胞培养板中,或过100um滤网后与基质胶混匀。
- 使用5-10ml组织清洗液反复吹打清洗。
- 吸去清洗液。
- 重复以上(b,c)两步,清洗组织5-10次。
- 原组织分析
- 取1-2块有代表性的组织块,用固定液进行固定(10%福尔马林或4%多聚甲醛)。
- 取1-2块有代表性的组织块,用RNAlater浸泡,-80℃速冻组织块,可进行分子(全外显子组/基因组测序或mRNA测序)或生化分析(Western blotting或蛋白质组学)。
- 组织剪切
- 将清洗后的组织块收集到1.5ml EP管中,使用无菌尖头眼科手术剪将组织块尽量剪碎。组织剪切程度与消化时间相关,剪切程度越高则消化时间越短。
- 将剪碎后的组织转移至15ml无菌离心管中。
- 组织消化
- 加入6ml组织消化液,使用封口膜将离心管管口密封,放入37℃水浴锅中水浴消化。
- 使用涡旋混匀仪,每隔5min震荡30s,并吸出30ul组织悬液显微镜下观察。
- 消化时间控制在40min,当视野中观察到悬液中有10-100个100um左右的细胞团快时,即可停止消化(如下图)。
【注4】:仔细观察消化状态,过度消化(消化为单细胞)会影响成功率以及降低生长效率。
【注5】:对于人肝癌组织应尽量剪碎,减短消化时间,消化时间控制在20-60min。
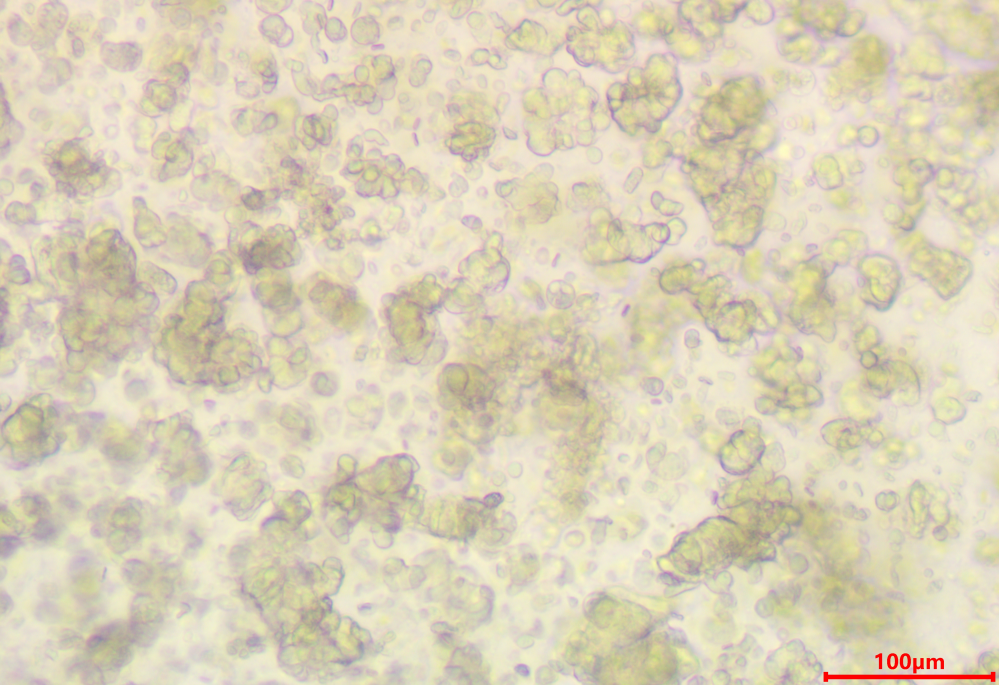
将组织与消化液悬液过100µm细胞滤网,加入清洗液补足至26ml。
【注6】:活检组织样本消化后为了减少细胞的丢失,不过滤,直接加入清洗液,300g/1500rpm离心5min后,弃上清。
- 将过滤后的细胞悬液均匀的分到两个15ml离心管中,300g/1500rpm/1500rpm,离心5min,离心后去上清。
- 若离心后沉淀中观察到明显的红色沉淀(红细胞),加入2ml红细胞裂解液,吹打混匀后室温放置3min。
【注7】:若组织离体时间超过48h,不建议进行红细胞裂解。
- 加入10ml清洗液。
- 300g/1500rpm离心5min后,弃上清。
- 培养
- 根据组织沉淀体积,按照V组织:V基质胶 = 1:10的比例加入低因子无酚红基质胶(基质胶提前一夜4℃溶解)。
- 置于冰上/冰盒上,使用200µl枪头吹打,将细胞沉淀与基质胶混匀。
- 若此过程基质胶中产生气泡,可将气泡以下的基质胶吸尽后,离心管用力敲打桌面,将气泡震破。
- 以24孔板为例,将基质胶-细胞悬液均匀的滴在培养孔中央,每滴20-60µl。
【注8】:a-d过程需要全程在冰上操作,离心结束后尽量将上清吸尽。基质胶浓度保持在70%以上,确保凝固后的基质胶保持穹顶状。
- 将滴有基质胶-细胞悬液的培养板放入37℃培养箱中,使基质胶凝固。
- 15min后每孔加入500µl室温平衡的人肝癌类器官培养基。
【注9】:根据实验需求,将所需体积的培养基提前放置室温平衡15min。
- 在37℃、5% CO2和21% O2细胞培养箱中培养。
- 每2-4天更换一次培养基。
【注10】:若细胞密度过高,培养1天后出现培养液变黄现象,需每天换液,且需尽快传代,稀释细胞密度。
- 若培养过程中出现微生物污染,可在对应的孔中加入1ml 3.5mM NaOH溶液,4h后吸弃液体。
- 类器官扩增
类器官是通过机械分散或机械破碎和酶法分散的组合来传代的。分解后的类器官经过清洗,并重悬在新的基质胶中。两种方法均不可将类器官过度消化为单细胞。
类器官消化液储存温度:-20℃ ~ 4℃。
- 类器官收集
- 吸弃原培养液。
- 缓慢少量加入预冷的清洗液(也可用含1%抗生素的PBS)。
- 吹打基质胶,将基质胶与类器官吹散。
【注11】:若有类器官出现贴壁,使用枪头将类器官刮下。
- 将类器官与清洗液混合液转移至 15ml 离心管中。
- 清洗液补足至12ml。
- 放入-20℃冰箱静置6min,或4℃冰箱静置30min。
【注12】:短暂的低温不会对类器官活性造成影响。利用基质胶低温溶解的特性,降温后离心去除。
- 300g/1500rpm 离心 5min ,弃上清。
- 类器官消化
机械分散:机械破碎适用于空泡状类器官或薄壁类器官。
- 加入1-2ml清洗液吹打。
- 当类器官大小为40-200um的细胞块时,即可停止。
- 清洗液补足至12ml后。
- 300g/1500rpm 离心 5min。
机械破碎和酶法分散:机械破碎和酶法分散适用于囊状类器官或厚壁状类器官(如下图)。
- 加入1-2ml室温平衡后的类器官消化液吹打。
- 每吹打2min倒置显微镜下观察此,消化液消化时间不可超过6min。
【注13】:注意防止消化过度,消化为单细胞。
- 当类器官大小为40-200um的细胞块时,即可停止。
- 清洗液补足至12ml后.
- 300g/1500rpm 离心 5min 弃上清。
- 扩增培养
- 根据类器官沉淀体积,按照V类器官:V基质胶=1:15的比例加入低因子无酚红基质胶(提前一夜4℃溶解)。
- 置于冰上/冰盒上,使用200µl枪头吹打,将细胞沉淀与基质胶混匀。
- 若此过程基质胶中产生气泡,可将气泡以下的基质胶吸尽后,离心管用力敲打桌面,将气泡震破。
- 以24孔板为例,将基质胶-细胞悬液均匀的滴在培养孔中央,每滴20-60µl。
【注14】:a-d过程需要全程在冰上操作,离心结束后尽量将上清吸尽。基质胶浓度保持在70%以上,确保凝固后的基质胶保持穹顶状。
- 将滴有基质胶-细胞悬液的培养板放入37℃培养箱中,使基质胶凝固。
- 15min后每孔加入500µl室温平衡的人肝癌类器官培养基。
【注15】:根据实验需求,将所需体积的培养基提前放置室温平衡15min。
- 在37℃、5% CO2和21% O2细胞培养箱中培养。
- 每2-4天更换一次培养基。
【注16】:若细胞密度过高,培养1天后出现培养液变黄现象,需每天换液,且需尽快传代,稀释细胞密度。
- 若培养过程中出现微生物污染,可在对应的孔中加入1ml 3.5mM NaOH溶液,4h后吸弃液体。
- 类器官冻存及复苏
类器官状态不佳时,进行冻存会影响复苏效率,因此冻存前的类器官必须处在最佳生长状态。选择类器官生长旺盛期进行冻存,根据不同样本的生长特性来选择最佳冻存时机,如生长快速的类器官传代直径或最大生长直径在300-500µm,则选择在类器官直径在150-200µm最佳;生长缓慢的类器官传代直径或最大生长直径为100-300µm,则选择类器官直径为100-150µm时冻存。
类器官冻存液储存温度:-20℃ ~ 4℃。
【注意】在类器官冻存过程中,需要尽量保持类器官的完整,因此在吹打时需要格外轻柔。
- 类器官收集
- 吸弃原培养液。
- 缓慢少量加入预冷的清洗液(也可用含1%抗生素的PBS)。
- 吹打基质胶,将基质胶与类器官吹散。
【注17】:若有类器官出现贴壁,使用枪头将类器官刮下。
- 将类器官与清洗液混合液转移至 15ml 离心管中。
- 清洗液补足至12ml。
- 放入-20℃冰箱静置6min,或4℃冰箱静置30min。
【注18】:短暂的低温不会对类器官活性造成影响。利用基质胶低温溶解的特性,降温后离心去除。
- 300g/1500rpm 离心 5min ,弃上清。
- 类器官冻存
- 根据类器官沉淀体积,按照V类器官:V冻存液=1:10的比例加入适量冻存液。
- 分装至冻存管中,使用程序降温法梯度降温。
- 经此方法冻存的类器官可在-80℃短期保存1个月,长期保存可转入液氮罐中。
- 类器官复苏
- 15ml离心管中加入2ml预先平衡至室温的清洗液(清洗液中可加入2%的血清)。
- 从液氮罐中取出冻存管,37℃水浴解冻1-2分钟。
【注19】:最佳解冻状态为冻存管中大部分为液体状态,中间稍微有一点冻滴,即冻存管中依然为低温状态(过度升温影响类器官活性)。
- 将解冻的类器官悬液缓慢转移至15ml离心管中。
- 加入8ml清洗液。
- 300g/1500rpm 离心 5min ,弃上清。
- 加入2ml预先平衡至室温的清洗液(无血清),轻柔吹打重悬类器官。
- 加入8ml清洗液。
- 300g/1500rpm 离心 5min ,弃上清。
- 复苏培养
- 根据类器官沉淀体积,按照V类器官:V基质胶=1:10的比例加入低因子无酚红基质胶(提前一夜4℃溶解)。
- 置于冰上/冰盒上,使用200µl枪头吹打,将细胞沉淀与基质胶混匀。
- 若此过程基质胶中产生气泡,可将气泡以下的基质胶吸尽后,离心管用力敲打桌面,将气泡震破。
- 以24孔板为例,将基质胶-细胞悬液均匀的滴在培养孔中央,每滴20-60µl。
【注20】:a-d过程需要全程在冰上操作,离心结束后尽量将上清吸尽。基质胶浓度保持在70%以上,确保凝固后的基质胶保持穹顶状。
- 将滴有基质胶-细胞悬液的培养板放入37℃培养箱中,使基质胶凝固。
- 15min后每孔加入500µl室温平衡的人肝癌类器官培养基。
【注21】:根据实验需求,将所需体积的培养基提前放置室温平衡15min。
- 在37℃、5% CO2和21% O2细胞培养箱中培养。
- 每2-4天更换一次培养基。
【注22】:若细胞密度过高,培养1天后出现培养液变黄现象,需每天换液,且需尽快传代,稀释细胞密度。
- 若培养过程中出现微生物污染,可在对应的孔中加入1ml 3.5mM NaOH溶液,4h后吸弃液体。
常见问题:
- 人肝癌组织取样方式
- 手术组织:针对肝癌肿瘤,尽量选择肿瘤实体部位进行取样,对于存在异质性的病变,应在全面观察的基础上多点取样。蓝色区域为肿瘤组织,避免采集到正常组织部位。至少取1块黄豆大小的富含肿瘤细胞的组织块。
- 肿块型病变,于病变顶部或侧缘表现为充血、糜烂、凹凸不平等部位取样。
- 结节型病变,鉴于多结节性肝癌具有单中心和多中心两种起源方式,在不能排除由肝内转移引起的卫星结节的情况下,单个肿瘤最大直径≤ 3 cm 的肝癌组织,应全部取材。
- 弥漫浸润型病变,于黏膜充血、肿胀、糜烂、溃疡、凹陷等病变显著的部位取样。
- 肿瘤坏死严重或有空洞形成时应尽量取材坏死不严重的周边区域。
- 实际取材的部位和数量还须根据肿瘤直径和数量等情况综合考虑。
- 活检组织:对肝癌可根据肿瘤生长方式选择深挖或多点采样的活检方式。至少取3块2~3mm大小富含肿瘤细胞的组织块。
- 取出肝癌组织后,使用清洗液清洗3-5次,尽快放入组织保存液中短暂保存。
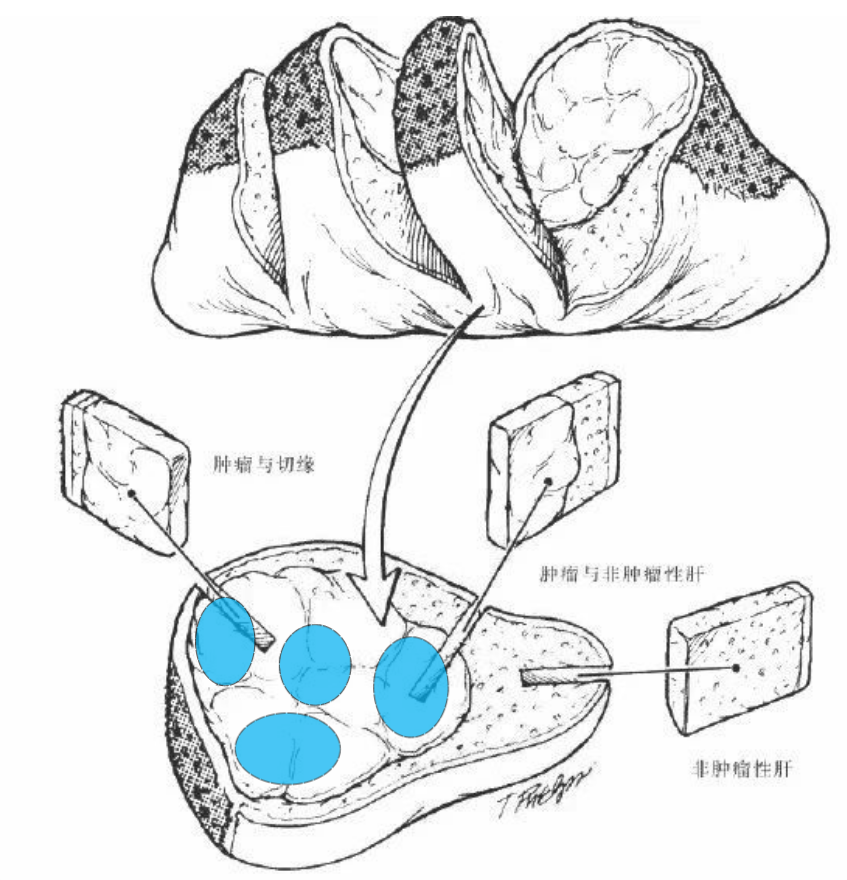

参考文献:外科病理取材图解指南.2009年.第四军医大学出版社。
- 人肝胸腹水取样
- 患者听诊、影像学检查发现胸腔积液,胸腔穿刺后发现胸腔积液浑浊、乳糜性、血性或脓性。
- 通过影像学或叩诊定位穿刺部位,消毒穿刺部位皮肤,麻醉穿刺部位,用中空孔针穿刺至胸膜腔内。
- 抽取胸水至500ml 无菌容器,过程尽量保持无菌。
【注23】:如果是浓稠血性胸腹水,加0.01%肝素钠抗凝,清澈透明或者黄色可以不加。
- 胸水收集后,密封,标注信息。
- 组织样本保存方式

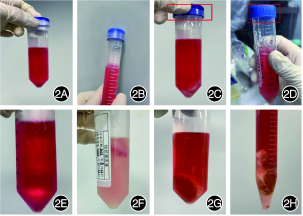
组织样本保存在保存液中,用封口膜密封保存液管盖 2A:正确;2B:错误(未缠封口膜);2C:正确(拧紧保存液管盖);2D:错误(管盖未拧紧);2E:正确(样本取出后将其放入红色保存液中);2F:错误(放入清洗液中);2G:正确(组织样本较大时,应放入含有保存液的50 mL离心管中);2H:错误(组织样本较大时,放入15 mL离心管中)。
参考文献:中国经内镜消化系统常见恶性肿瘤组织取样及类器官培养专家共识(2024).中华消化内镜杂志.2024;41(5):337-350.
- 组织运输方式
- 使用气泡膜/纱布/无菌纸巾将浸泡有组织的组织保存管包裹一圈,防止冰袋与保存管直接接触。
- 放入保温泡沫箱中,加入2-4个冰袋,保持0~8℃快递运输。
- 收到货后,根据步骤一、从原代组织建立类器官流程,尽快处理组织样本。





